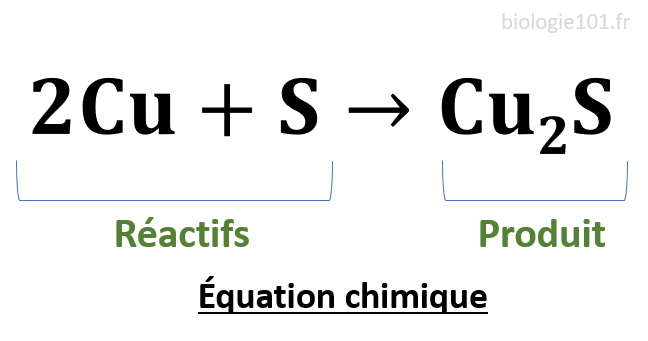Une réaction chimique est une transformation de la matière au cours de laquelle des liaisons chimiques sont créés ou rompues et impliquant des transferts d’électrons entre deux ou plusieurs atomes.
Sommaire
Équation chimique
Une équation chimique est la traduction des réarrangements d’atomes au cours d’une réaction chimique. A gauche, on trouve les réactifs qui vont subir la réaction et à droite on trouve le ou les produits résultat de cette réaction.
Une réaction chimique est dite réversible lorsqu’elle peut avoir lieu dans les deux sens et irréversible lorsqu’elle ne peut se dérouler que dans un seul sens (de la gauche vers la droite). Une réaction chimique doit toujours être équilibrée, c’est-à-dire que le nombre d’atomes doit être le même des deux côtés de l’équation.
Types de réactions chimiques
En fonction de la redistribution des atomes dans le résultat de la réaction, il est possible de définir des catégories de réactions :
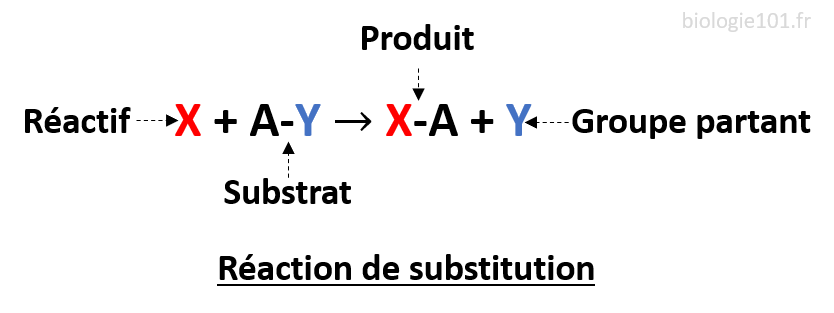
Réaction de substitution
Une réaction de substitution se produit lorsqu’un atome ou un groupement va remplacer un autre atome ou un groupement dans une autre molécule.
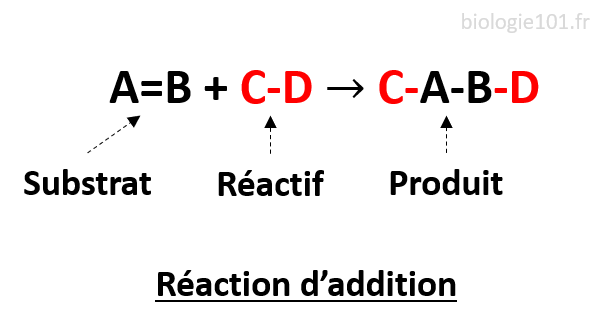
Réaction d’addition
Une réaction d’addition a lieu lorsqu’un des réactifs va se scinder et les deux parties vont aller se fixer sur l’autre réactif.
Réaction d’élimination
Une molécule perd des atomes qui vont s’associer pour former des produits stables.
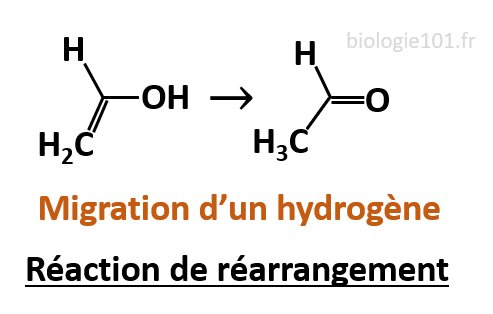
Réaction de réarrangement
Des atomes ou des groupements changent de place au sein même de la molécule, sans gain ni perte d’atomes.
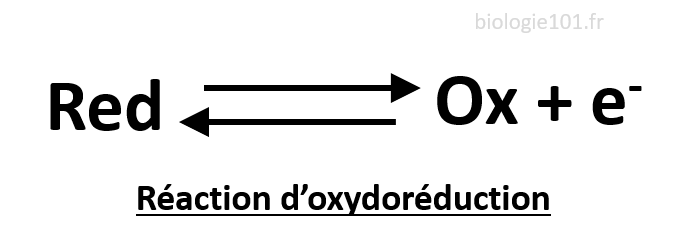
Réaction d’oxydoréduction
C’est une réaction chimique dans laquelle a lieu un transfert d’électrons. Une oxydation est une perte d’électrons. Le réactant qui perd des électrons est dit oxydé. Une réduction est un gain d’électrons. Le réactant qui gagne des électrons est dit réduit.
Énergie et réaction chimique
Une réaction est exothermique lorsque l’énergie est cédée par le système. Une réaction est endothermique lorsque l’énergie est absorbée par le système.
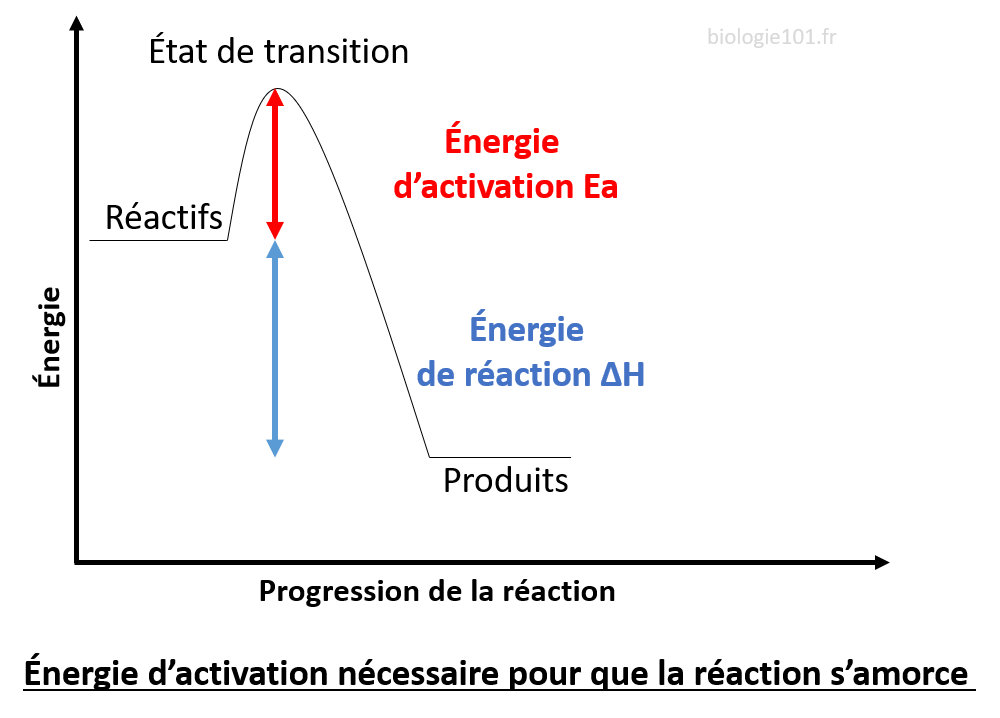
Énergie d’activation
Avant d’obtenir les produits, les réactifs doivent passer par un état de transition (état instable qu’on ne peut pas observer). L’énergie d’activation Ea est l’énergie requise pour passer vers cet état de transition et pour que la réaction ait lieu. En effet, pour que des produits puissent se former à partir de réactants, ceux-ci doivent d’une part d’abord rompre leurs éventuelles liaisons initiales s’il s’agit de molécule et d’autre part pouvoir se rencontrer afin de créer de nouvelles liaisons.
Vitesse de réaction
En réduisant l’énergie d’activation, on augmente la vitesse de réaction. Plusieurs facteurs peuvent intervenir dans la vitesse de réaction, on peut citer entre autres :
- La concentration des réactifs : Plus la concentration est élevée, plus la probabilité que les réactants interagissent sera élevée et donc plus la vitesse de réaction est grande.
- La température : Plus la température est élevée, plus l’énergie cinétique des molécules sera élevée (et donc leurs mouvements) et plus la probabilité qu’elles se rencontrent sera grande.
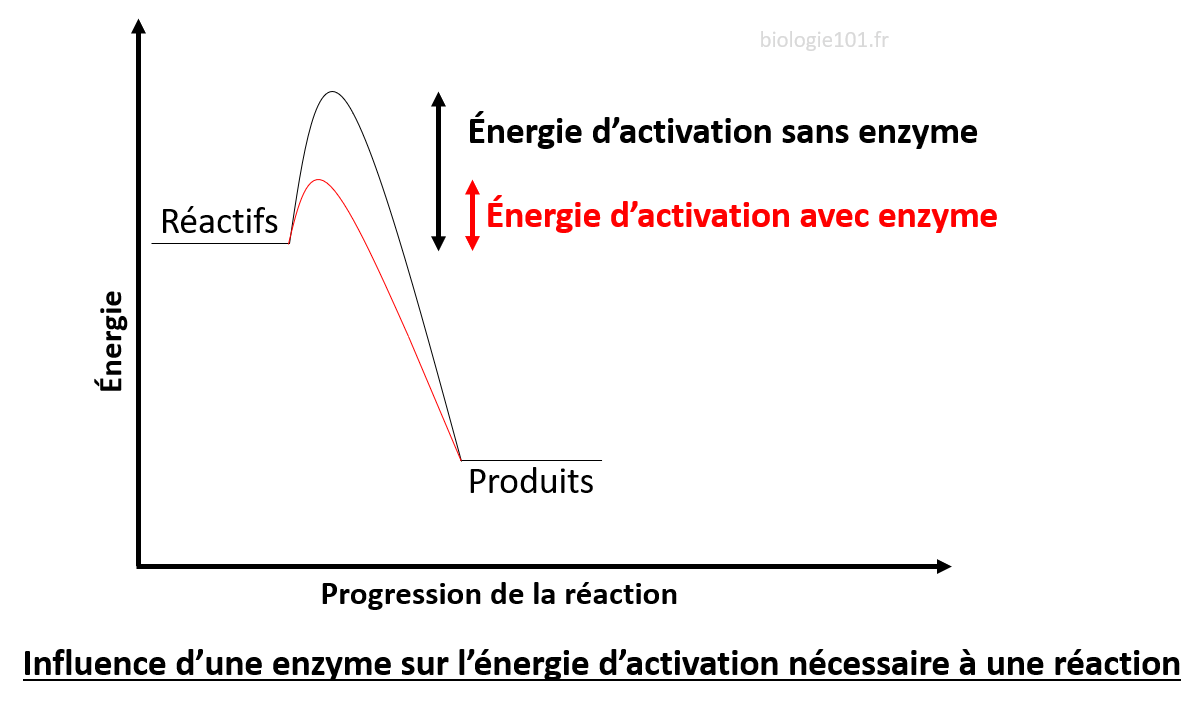
- La présence d’un catalyseur : c’est une substance chimique qui augmente la vitesse de réaction en modifiant les mécanismes de réaction, abaissant ainsi l’énergie d’activation. Un catalyseur ne modifie ni la structure des réactants, ni celle des produits. De plus, il n’est pas consommé lors de la réaction chimique.
- La présence d’enzymes : les enzymes des catalyseurs biologiques. Ce sont des protéines qui interagissent avec les réactants et facilitent la réaction chimique. Le site actif est une région de l’enzyme où les réactants (appelés substrats dans une réaction enzymatique) se lient..