Liaison chimique et valence
Une liaison chimique est une interaction attractive entre deux ou plusieurs atomes. Les liaisons chimiques ne font pas intervenir de structures physiques. Une molécule est formée par la liaison de deux ou plusieurs atomes d’un même élément (exemple le dioxygène O2).
Un composé chimique est composé d’au moins deux éléments chimiques dont les molécules sont formées par la liaison de deux ou plusieurs atomes différents comme par exemple l’eau H2O ou l’acide sulfurique H2SO4.
La valence est la capacité de liaison d’un atome avec un autre. La valence est fonction de la configuration électronique de la dernière couche d’électrons.
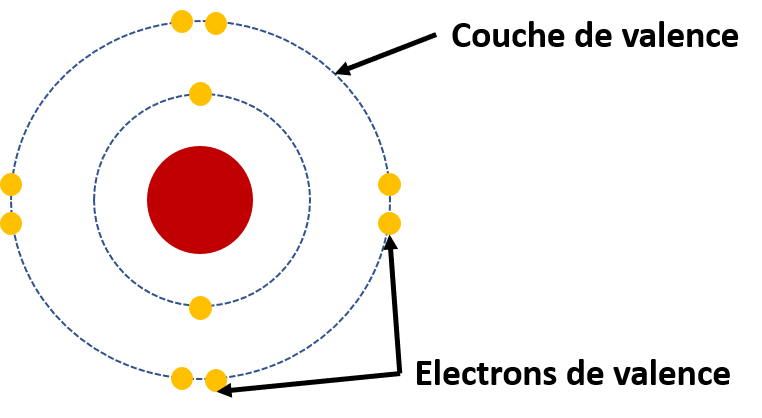
Les atomes ont tendance à rechercher la configuration électronique la plus stable, c’est-à-dire avoir le nombre maximal d’électrons dans la couche de valence afin d’avoir la même configuration électronique du gaz noble le plus proche dans le tableau périodique des éléments.
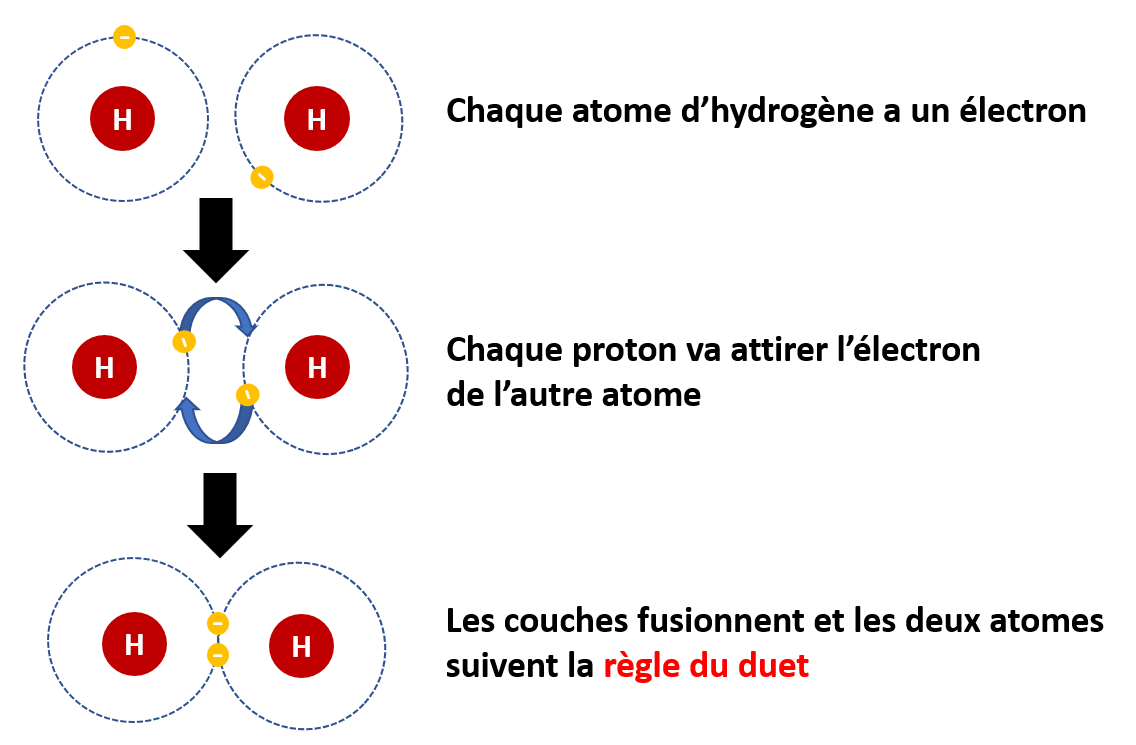
Règle du duet : elle concerne les trois premiers éléments Hydrogène, Hélium (gaz noble) et Lithium. Ces éléments sont plus stables lorsqu’ils possèdent deux électrons dans leur couche de valence. L’hydrogène H (qui ne possède qu’un seul électron) cherchera donc à gagner un électron pour former l’ion H- alors que le Lithium Li (qui possède trois électrons) cherchera à perdre un électron pour former l’ion Li+.
Règle de l’octet : le principe est le même que celui de la règle du duet. Elle s’applique pour les atomes qui sont plus stables lorsque leur couche de valence a 8 électrons, toujours pour se rapprocher de la configuration électronique d’un gaz noble. Parmi les atomes d’intérêt en biologie qui suivent cette règle, on peut citer le carbone C, l’azote N, l’oxygène O.
La liaison covalente
Une liaison est covalente lorsque les électrons sont partagés entre atomes, ce qui entraine la formation d’une molécule.
On parle de liaison simple lorsqu’une seule paire d’électrons est partagée (chaque atome fournit un électron), de liaison double lorsque deux paires d’électrons sont partagées (chaque atome fournit deux électrons) et de liaison triple lorsqu’il s’agit de trois paires d’électrons (chaque atome fournit trois électrons).
Il existe deux types de liaison covalente :
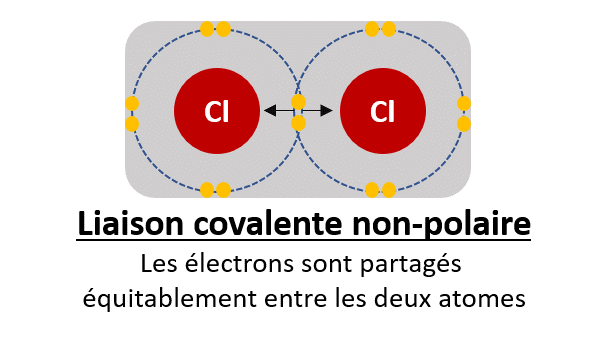
- Liaison covalente non polaire : La distribution des électrons entre les deux atomes est uniforme, la molécule ainsi crée est électriquement neutre.
- Liaison covalente polaire : La distribution des électrons entre les deux atomes n’est pas uniforme, il en résulte un atome qui devient partiellement négatif (δ-) et l’autre atome qui devient partiellement positif (δ+). Dans ce cas la molécule formera un dipôle avec un pôle positif et un pôle négatif.
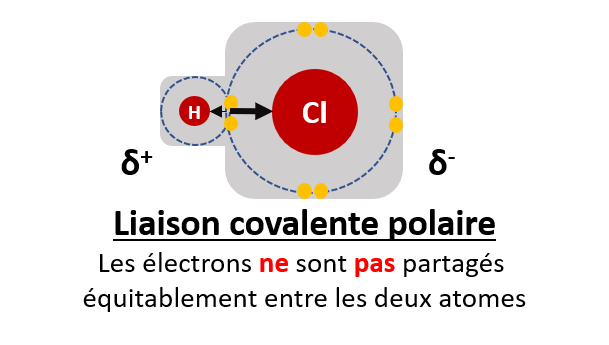
La liaison ionique
Les ions se forment lorsque les atomes perdent ou gagnent un ou plusieurs électrons. Lorsqu’un atome perd un électron il devient un cation (chargé positivement). Lorsqu’un atome gagne un électron, il devient un anion (chargé négativement).
Une liaison ionique s'établit lorsqu’il y a un transfert d’électrons entre deux atomes. L’un deviendra un cation chargé positivement et l’autre un anion chargé négativement et s’attireront mutuellement.
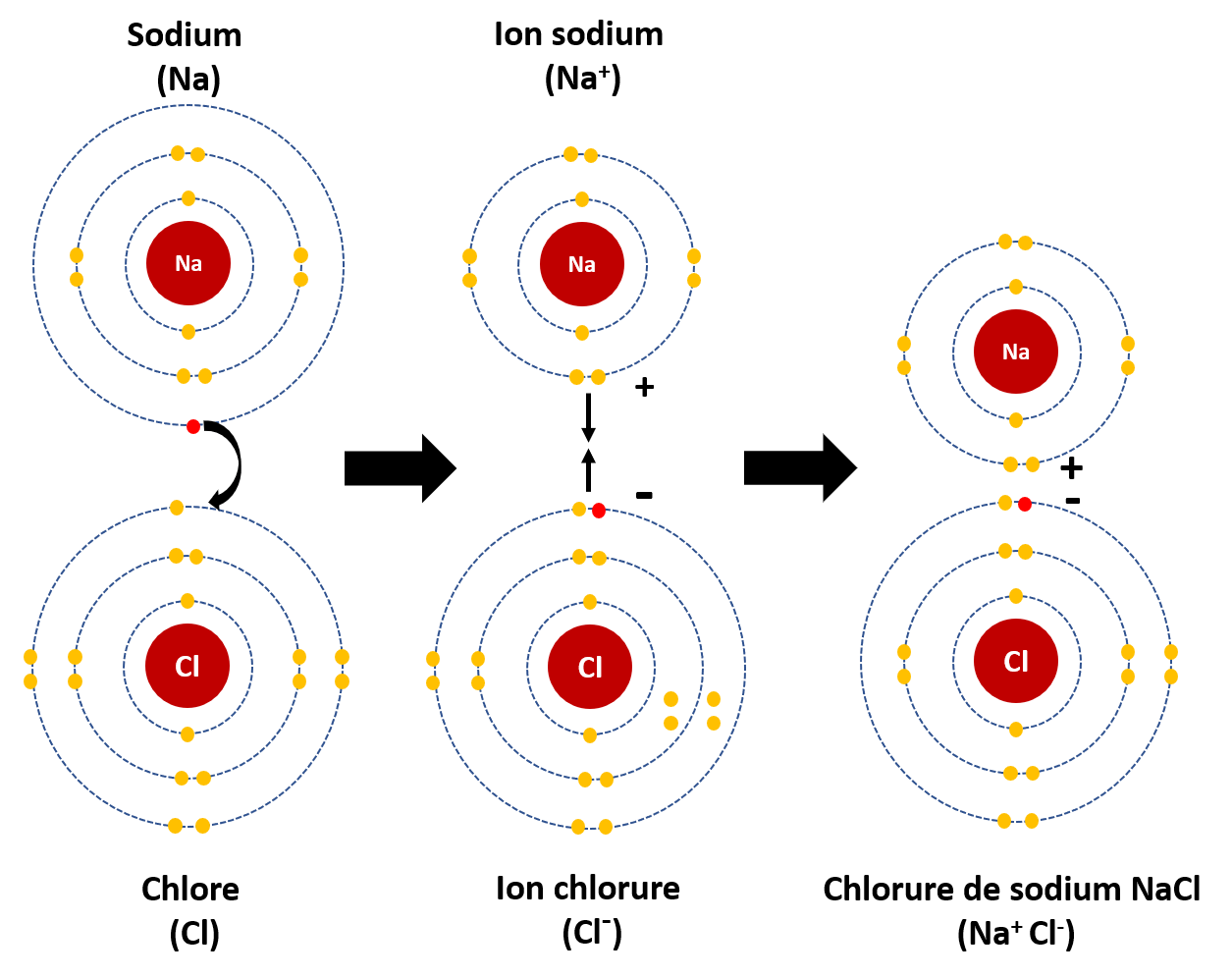
C'est le cas par exemple du chlorure de sodium NaCl dans lequel le sodium Na a transféré un électron à l’atome de chlore Cl, devenant respectivement l’ion Na+ et l’ion Cl-. Les deux charges opposées s’attirent pour former le NaCl. Les composés ioniques formés de cations et d’anions sont appelés des sels.
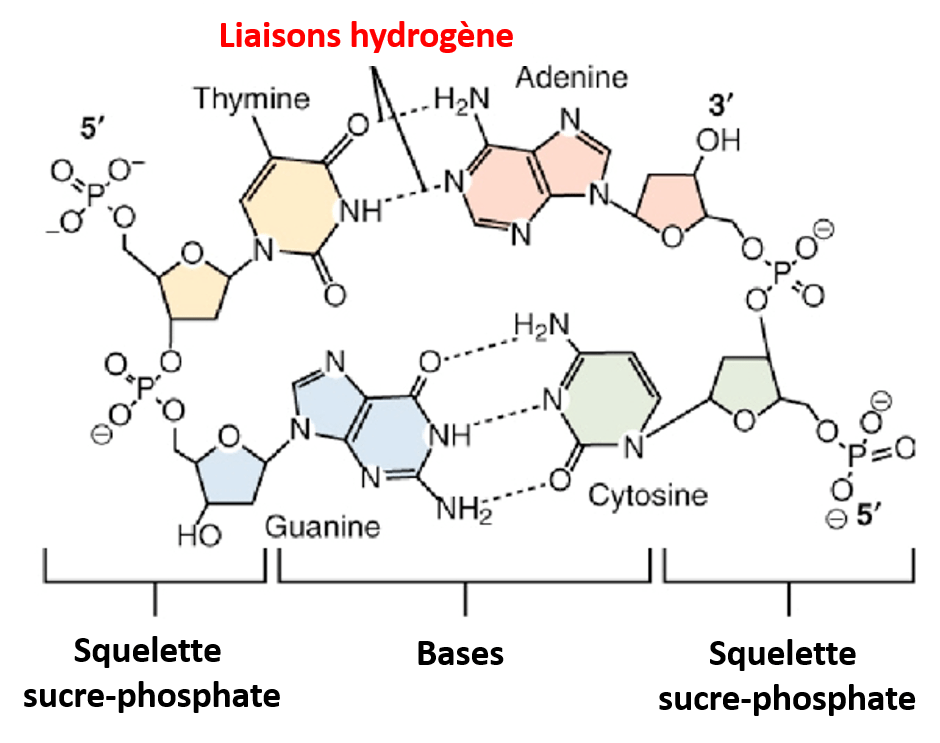
La liaison hydrogène
Dans une molécule polaire, la charge partiellement positive δ+ des atomes d’hydrogène a tendance à attirer les atomes partiellement chargés négativement (δ-) des autres molécules polaires.

Les liaisons hydrogènes peuvent se former entre molécules mais aussi à l’intérieur d’une même molécule, modifiant ainsi la forme de la molécule ou maintenant l’intégrité de celle-ci. Par exemple, c’est le cas dans la molécule d’ADN où l’adénine et la thymine sont liées par deux liaisons hydrogène, la guanine et la cytosine sont liées par trois liaisons hydrogène.