Structure de l’atome et couche électronique
Un atome est la plus petite partie stable de la matière capable de réagir chimiquement avec un autre. L’atome est constitué d’un noyau atomique entouré d’un nuage d’électrons.
- Le noyau atomique est composé de protons p+ (charge électrique positive) et de neutrons n0(sans charge électrique, neutre). L’ensemble protons et neutrons forme les nucléons
- Le nuage électronique (divisé en couche) autour du noyau est composé d’électrons e- (charge électrique négative).
Les atomes sont électriquement neutres, il y a autant de protons chargés positif que d’électrons chargés négatif.
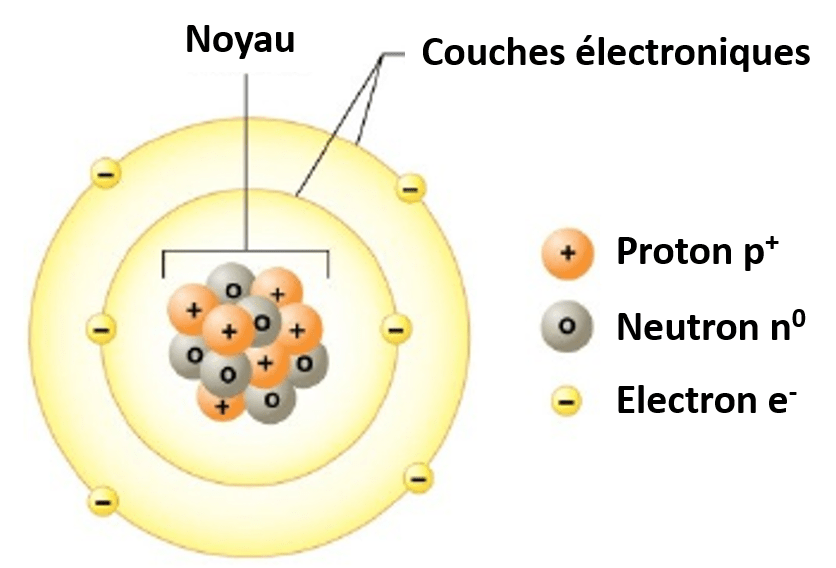
Atome composé d'un noyau et d'électrons
Les couches électroniques sont les orbitales au niveau desquelles orbitent les électrons. Il y a 7 couches électroniques (K est l’orbite la plus proche du noyau, Q est l’orbite la plus éloignée) qui peuvent contenir chacune un nombre précis d’électrons : la première couche peut contenir 2 électrons, la deuxième jusqu’à 8 électrons, la troisième jusqu’à 18 électrons, etc.
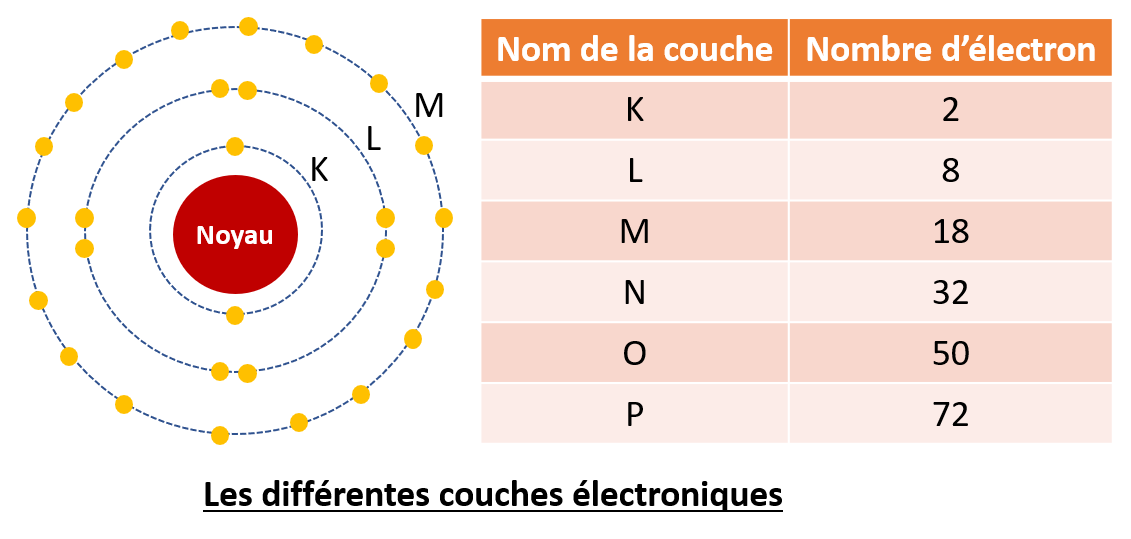
Les couches électroniques d'un atome
Les atomes sont identifiés par leur numéro atomique et leur nombre de masse. Le numéro atomique est le nombre de protons. Le nombre de masse est le nombre de protons et de neutrons.
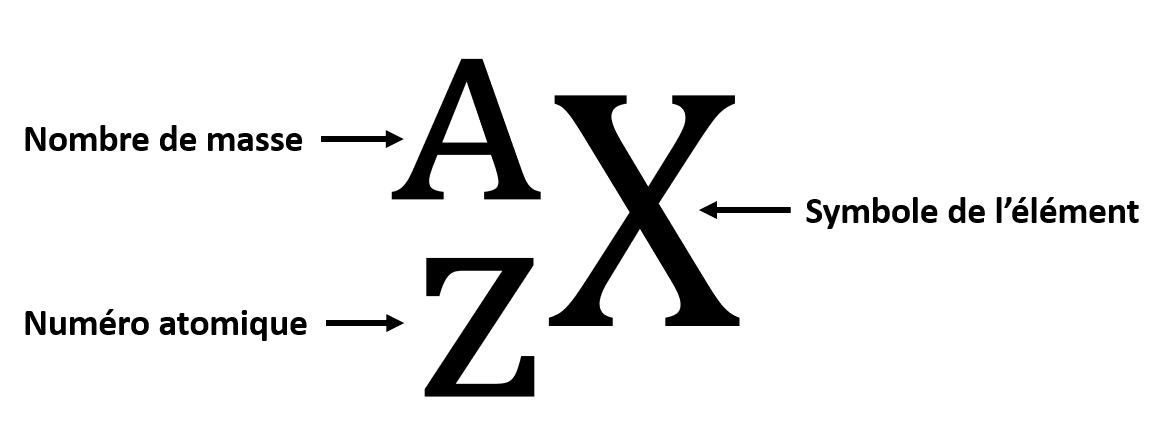
Numéro atomique et nombre de masse d'un atome
Notion d’éléments et d’isotopes
Un élément est composé uniquement d’atomes avec le même nombre atomique.
Les isotopes sont les différents atomes du même élément. Les isotopes d’un élément ont le même numéro atomique Z mais leur nombre de masse A est différent (différent nombre de neutrons).
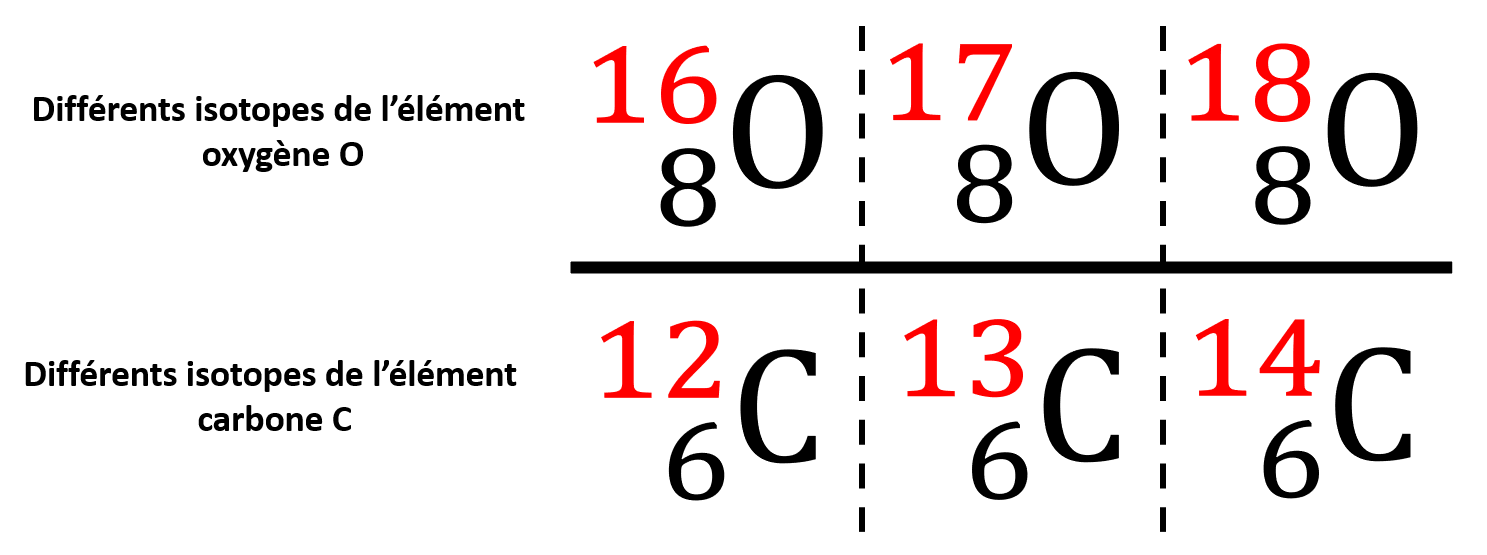
Les isotopes du Carbone et de l'Oxygène
Les états de la matière et les différents types de mélanges
La matière est définie comme tout ce qui a une masse et occupe un espace. Il existe trois états de la matière :
- Les solides ont une forme et un volume définis dans les conditions de températures et de pressions ordinaires.
- Les liquides ont un volume constant mais leur forme s’adapte au conteneur.
- Les gaz n’ont ni volume ni forme définis. Ils peuvent être comprimés ou détendus.
Un mélange contient au moins deux espèces chimiques différentes. Lorsqu’une substance se distingue des autres dans un mélange, elle forme une phase.
Le mélange est homogène lorsqu’on ne distingue qu’une seule phase et hétérogène lorsqu’on distingue au moins deux phases.
Il existe plusieurs types de mélanges :
- Une suspension est un mélange hétérogène contenant deux ou plusieurs substances avec de larges particules distribuées inégalement. Les particules se déposent au fond au cours du temps si la suspension n’est pas en mouvement (phénomène de sédimentation). Il est possible de séparer les deux substances par filtration.
- Un colloïde est un mélange hétérogène où deux ou plusieurs substances sont distribuées également (par exemple le lait est un colloïde composé d’eau et de protéines). Les substances qui composent un colloïde ne se séparent ni au cours du temps ni par filtration.
- Une solution est un mélange homogène composé d’au moins deux substances dont l’une est dissoute dans l’autre. La substance dissoute est appelée soluté et la substance dans laquelle le soluté est dissout est appelée solvant. Par exemple du sucre dans de l’eau, le sucre est le soluté, l’eau est le solvant. Le soluté ne peut pas être séparé du solvant par filtration.